近年來,急性ST段抬高型心肌梗死(STEMI)的診斷和治療取得了重要進展,第三版"心肌梗死全球定義"已公布,歐洲心髒病學學會、美國心髒病學院基金會和美國心髒協會對STEMI治療指南作了修訂,歐洲心肌血運重建指南也已發表。本指南主要闡述1型心肌梗死(即缺血相關的自發性急性STEMI)的診斷和治療。
五、再灌注治療
(一)溶栓治療
1.總體考慮
溶栓治療快速、簡便,在不具備PCI條件的醫院或因各種原因使FMC至PCI時間明顯延遲時,對有適應證的STEMI患者,靜脈內溶栓仍是較好的選擇。院前溶栓效果優於入院後溶栓。對發病3 h內的患者,溶栓治療的即刻療效與直接PCI基本相似;有條件時可在救護車上開始溶栓治療(Ⅱa,A)。
但目前我國大部分地區溶栓治療多在醫院內進行。決定是否溶栓治療時,應綜合分析預期風險/效益比、發病至就診時間、就診時臨床及血液動力學特征、合並症、出血風險、禁忌證和預期PCI延誤時間。左束支傳導阻滯、大麵積梗死(前壁心肌梗死、下壁心肌梗死合並右心室梗死)患者溶栓獲益較大。
2.適應證
(1)發病12 h以內,預期FMC至PCI時間延遲大於120 min,無溶栓禁忌證(Ⅰ,A);
(2)發病12~24 h仍有進行性缺血性胸痛和至少2個胸前導聯或肢體導聯ST段抬高>0.1 mV,或血液動力學不穩定的患者,若無直接PCI條件,溶栓治療是合理的(Ⅱa,C);
(3)計劃進行直接PCI前不推薦溶栓治療(Ⅲ,A);
(4)ST段壓低的患者(除正後壁心肌梗死或合並aVR導聯ST段抬高)不應采取溶栓治療(Ⅲ,B);
(5)STEMI發病超過12 h,症狀已緩解或消失的患者不應給予溶栓治療(Ⅲ,C)。
3.禁忌證
絕對禁忌證包括:
(1)既往腦出血史或不明原因的卒中;
(2)已知腦血管結構異常;
(3)顱內惡性腫瘤;
(4)3個月內缺血性卒中(不包括4.5 h內急性缺血性卒中);
(5)可疑主動脈夾層;
(6)活動性出血或出血素質(不包括月經來潮);
(7)3個月內嚴重頭部閉合傷或麵部創傷;
(8)2個月內顱內或脊柱內外科手術;
(9)嚴重未控製的高血壓[收縮壓>180 mmHg和(或)舒張壓>110 mmHg,對緊急治療無反應]。
相對禁忌證包括:
(1)年齡≥75歲;
(2)3個月前有缺血性卒中;
(3)創傷(3周內)或持續>10 min心肺複蘇;
(4)3周內接受過大手術;
(5)4周內有內髒出血;
(6)近期(2周內)不能壓迫止血部位的大血管穿刺;
(7)妊娠;
(8)不符合絕對禁忌證的已知其他顱內病變;
(9)活動性消化性潰瘍;
(10)正在使用抗凝藥物[國際標準化比值(INR)水平越高,出血風險越大]。
4.溶栓劑選擇
建議優先采用特異性纖溶酶原激活劑。重組組織型纖溶酶原激活劑阿替普酶可選擇性激活纖溶酶原,對全身纖溶活性影響較小,無抗原性,是目前最常用的溶栓劑。但其半衰期短,為防止梗死相關動脈再阻塞需聯合應用肝素(24~48 h)。其他特異性纖溶酶原激活劑還有蘭替普酶、瑞替普酶和替奈普酶等。非特異性纖溶酶原激活劑包括尿激酶和尿激酶原,可直接將循環血液中的纖溶酶原轉變為有活性的纖溶酶,無抗原性和過敏反應(表2)。
表2 不同溶栓藥物特征的比較
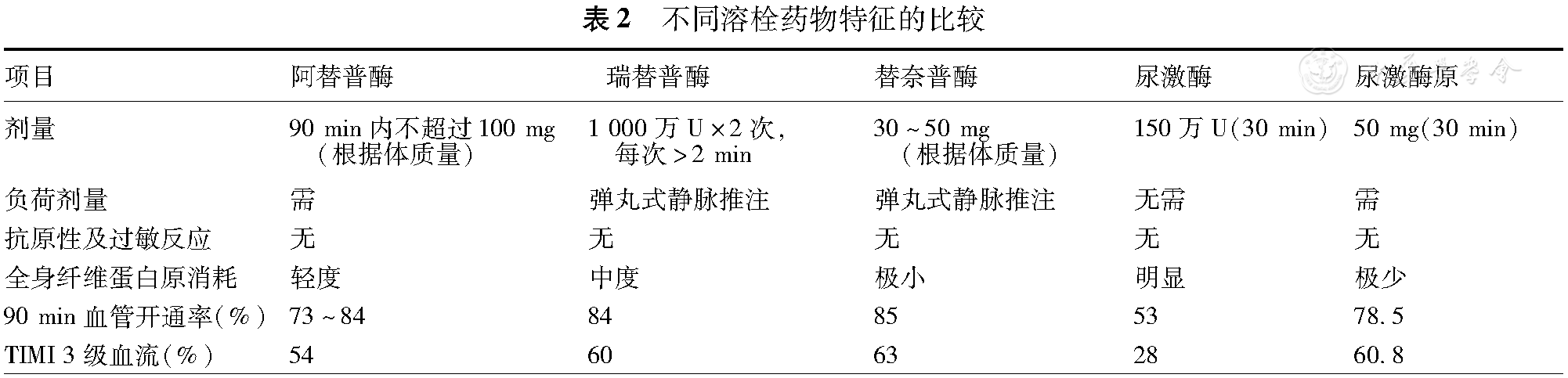
5.劑量和用法
阿替普酶:全量90 min加速給藥法:首先靜脈推注15 mg,隨後0.75 mg/kg在30 min內持續靜脈滴注(最大劑量不超過50 mg),繼之0.5 mg/kg於60 min持續靜脈滴注(最大劑量不超過35 mg)。半量給藥法:50 mg溶於50 ml專用溶劑,首先靜脈推注8 mg,其餘42 mg於90 min內滴完。
替奈普酶:30~50 mg溶於10 ml生理鹽水中,靜脈推注(如體質量<60 kg,劑量為30 mg;體質量每增加10 kg,劑量增加5 mg,最大劑量為50 mg)。
尿激酶:150萬U溶於100 ml生理鹽水,30 min內靜脈滴入。溶栓結束後12 h皮下注射普通肝素7 500 U或低分子肝素,共3~5 d。
重組人尿激酶原:20 mg溶於10 ml生理鹽水,3 min內靜脈推注,繼以30 mg溶於90 ml生理鹽水,30 min內靜脈滴完。
6.療效評估
溶栓開始後60~180 min內應密切監測臨床症狀、心電圖ST段變化及心律失常。
血管再通的間接判定指標包括:
(1)60~90 min內心電圖抬高的ST段至少回落50%。
(2)cTn峰值提前至發病12 h內,CK-MB酶峰提前到14 h內。
(3)2 h內胸痛症狀明顯緩解。
(4)2~3 h內出現再灌注心律失常,如加速性室性自主心律、房室傳導阻滯(AVB)、束支阻滯突然改善或消失,或下壁心肌梗死患者出現一過性竇性心動過緩、竇房傳導阻滯,伴或不伴低血壓。
上述4項中,心電圖變化和心肌損傷標誌物峰值前移最重要。
冠狀動脈造影判斷標準:心肌梗死溶栓(TIMI)2或3級血流表示血管再通,TIMI 3級為完全性再通,溶栓失敗則梗死相關血管持續閉塞(TIMI 0~1級)。
7.溶栓後處理
對於溶栓後患者,無論臨床判斷是否再通,均應早期(3~24 h內)進行旨在介入治療的冠狀動脈造影;溶栓後PCI的最佳時機仍有待進一步研究。無冠狀動脈造影和(或)PCI條件的醫院,在溶栓治療後應將患者轉運到有PCI條件的醫院(Ⅰ,A)。
8.出血並發症及其處理
溶栓治療的主要風險是出血,尤其是顱內出血(0.9%~1.0%)。高齡、低體質量、女性、既往腦血管疾病史、入院時血壓升高是顱內出血的主要危險因素。一旦發生顱內出血,應立即停止溶栓和抗栓治療;進行急診CT或磁共振檢查;測定紅細胞比容、血紅蛋白、凝血酶原、活化部分凝血活酶時間(APTT)、血小板計數和纖維蛋白原、D-二聚體,並檢測血型及交叉配血。治療措施包括降低顱內壓;4 h內使用過普通肝素的患者,推薦用魚精蛋白中和(1 mg魚精蛋白中和100 U普通肝素);出血時間異常可酌情輸入6~8 U血小板。
(二)介入治療
開展急診介入的心導管室每年PCI量≥100例,主要操作者具備介入治療資質且每年獨立完成PCI≥50例。開展急診直接PCI的醫院應全天候應診,並爭取STEMI患者首診至直接PCI時間≤90 min。
1.直接PCI
根據以下情況作出直接PCI決策。
Ⅰ類推薦
(1)發病12 h內(包括正後壁心肌梗死)或伴有新出現左束支傳導阻滯的患者(證據水平A);
(2)伴心原性休克或心力衰竭時,即使發病超過12 h者(證據水平B);
(3)常規支架置入(證據水平A);
(4)一般患者優先選擇經橈動脈入路(證據水平B),重症患者可考慮經股動脈入路。
Ⅱa類推薦
(1)發病12~24 h內具有臨床和(或)心電圖進行性缺血證據(證據水平B);
(2)除心原性休克或梗死相關動脈PCI後仍有持續性缺血外,應僅對梗死相關動脈病變行直接PCI(證據水平B);
(3)冠狀動脈內血栓負荷大時建議應用導管血栓抽吸(證據水平B);
(4)直接PCI時首選藥物洗脫支架(DES)(證據水平A)。
Ⅲ類推薦
(1)無血液動力學障礙患者,不應對非梗死相關血管進行急診PCI(證據水平C);
(2)發病超過24 h、無心肌缺血、血液動力學和心電穩定的患者不宜行直接PCI(證據水平C);
(3)不推薦常規使用主動脈內氣囊反搏泵(IABP)(證據水平A);
(4)不主張常規使用血管遠端保護裝置(證據水平C)。
2.溶栓後PCI
溶栓後盡早將患者轉運到有PCI條件的醫院,溶栓成功者於3~24 h進行冠狀動脈造影和血運重建治療(Ⅱa,B);溶栓失敗者盡早實施挽救性PCI(Ⅱa,B)。
溶栓治療後無心肌缺血症狀或血液動力學穩定者不推薦緊急PCI(Ⅲ,C)。
3.FMC與轉運PCI
若STEMI患者首診於無直接PCI條件的醫院,當預計FMC至PCI的時間延遲<120 min時,應盡可能地將患者轉運至有直接PCI條件的醫院(Ⅰ,B);如預計FMC至PCI的時間延遲>120 min,則應於30 min內溶栓治療。根據我國國情,也可以請有資質的醫生到有PCI設備的醫院行直接PCI(時間<120 min)(Ⅱb,B)。
4.未接受早期再灌注治療STEMI患者的PCI(症狀發病>24 h)
病變適宜PCI且有再發心肌梗死、自發或誘發心肌缺血或心原性休克或血液動力學不穩定的患者建議行PCI治療(Ⅰ,B)。
左心室射血分數(LVEF)<0.40、有心力衰竭、嚴重室性心律失常者應常規行PCI(Ⅱa,C);STEMI急性發作時有臨床心力衰竭的證據,但發作後左心室功能尚可(LVEF>0.40)的患者也應考慮行PCI(Ⅱa,C)。
對無自發或誘發心肌缺血證據,但梗死相關動脈有嚴重狹窄者可於發病24 h後行PCI(Ⅱb,C)。
對梗死相關動脈完全閉塞、無症狀的1~2支血管病變,無心肌缺血表現,血液動力學和心電穩定患者,不推薦發病24 h後常規行PCI(Ⅲ,B)。
5.STEMI直接PCI時無複流的防治
綜合分析臨床因素和實驗室測定結果,有利於檢出直接PCI時發生無複流的高危患者。應用血栓抽吸導管(Ⅱa,B)、避免支架置入後過度擴張、冠狀動脈內注射替羅非班、鈣拮抗劑等藥物(Ⅱb,B)有助於預防或減輕無複流。在嚴重無複流患者,IABP有助於穩定血液動力學。
(三)CABG
當STEMI患者出現持續或反複缺血、心原性休克、嚴重心力衰竭,而冠狀動脈解剖特點不適合行PCI或出現心肌梗死機械並發症需外科手術修複時可選擇急診CABG。
六、抗栓治療
STEMI的主要原因是冠狀動脈內斑塊破裂誘發血栓性阻塞。因此,抗栓治療(包括抗血小板和抗凝)十分必要(Ⅰ,A)。
(一)抗血小板治療
1.阿司匹林
通過抑製血小板環氧化酶使血栓素A2合成減少,達到抗血小板聚集的作用。所有無禁忌證的STEMI患者均應立即口服水溶性阿司匹林或嚼服腸溶阿司匹林300 mg(Ⅰ,B),繼以75~100 mg/d長期維持(Ⅰ,A)。
2.P2Y12受體抑製劑
幹擾二磷酸腺苷介導的血小板活化。氯吡格雷為前體藥物,需肝髒細胞色素P450酶代謝形成活性代謝物,與P2Y12受體不可逆結合。替格瑞洛和普拉格雷具有更強和快速抑製血小板的作用,且前者不受基因多態性的影響。
STEMI直接PCI(特別是置入DES)患者,應給予負荷量替格瑞洛180 mg,以後90 mg/次,每日2次,至少12個月(Ⅰ,B);或氯吡格雷600 mg負荷量,以後75 mg/次,每日1次,至少12個月(Ⅰ,A)。
腎功能不全(腎小球濾過率<60 ml/min)患者無需調整P2Y12受體抑製劑用量。
STEMI靜脈溶栓患者,如年齡≤75歲,應給予氯吡格雷300 mg負荷量,以後75 mg/d,維持12個月(Ⅰ,A)。如年齡>75歲,則用氯吡格雷75 mg,以後75 mg/d,維持12個月(Ⅰ,A)。
挽救性PCI或延遲PCI時,P2Y12抑製劑的應用與直接PCI相同。
未接受再灌注治療的STEMI患者可給予任何一種P2Y12受體抑製劑,例如氯吡格雷75 mg、1次/d,或替格瑞洛90 mg、2次/d,至少12個月(Ⅰ,B)。
正在服用P2Y12受體抑製劑而擬行CABG的患者應在術前停用P2Y12受體抑製劑,擇期CABG需停用氯吡格雷至少5 d,急診時至少24 h(Ⅰ,B);替格瑞洛需停用5 d,急診時至少停用24 h(Ⅰ,B)。
STEMI合並房顫需持續抗凝治療的直接PCI患者,建議應用氯吡格雷600 mg負荷量,以後每天75 mg(Ⅱa,B)。
3.血小板糖蛋白(glycoprotein,GP)Ⅱb/Ⅲa受體拮抗劑
在有效的雙聯抗血小板及抗凝治療情況下,不推薦STEMI患者造影前常規應用GPⅡb/Ⅲa受體拮抗劑(Ⅱb,B)。
高危患者或造影提示血栓負荷重、未給予適當負荷量P2Y12受體抑製劑的患者可靜脈使用替羅非班或依替巴肽(Ⅱa,B)。
直接PCI時,冠狀動脈脈內注射替羅非班有助於減少無複流、改善心肌微循環灌注(Ⅱb,B)。
(二)抗凝治療
1.直接PCI患者
靜脈推注普通肝素(70~100 U/kg),維持活化凝血時間(ACT)250~300 s。聯合使用GPⅡb/Ⅲa受體拮抗劑時,靜脈推注普通肝素(50~70 U/kg),維持ACT 200~250 s(Ⅰ,B)。
或者靜脈推注比伐盧定0.75 mg/kg,繼而1.75 mg kg-1 h-1靜脈滴注(合用或不合用替羅非班)(Ⅱa,A),並維持至PCI後3~4 h,以減低急性支架血栓形成的風險。
出血風險高的STEMI患者,單獨使用比伐盧定優於聯合使用普通肝素和GPⅡb/Ⅲa受體拮抗劑(Ⅱa,B)。
使用肝素期間應監測血小板計數,及時發現肝素誘導的血小板減少症。磺達肝癸鈉有增加導管內血栓形成的風險,不宜單獨用作PCI時的抗凝選擇(Ⅲ,C)。
2.靜脈溶栓患者
應至少接受48 h抗凝治療(最多8 d或至血運重建)(Ⅰ,A)。
建議:
(1)靜脈推注普通肝素4 000 U,繼以1 000 U/h滴注,維持APTT 1.5~2.0倍(約50~70 s)(Ⅰ,C);
(2)根據年齡、體質量、肌酐清除率(CrCl)給予依諾肝素。年齡<75歲的患者,靜脈推注30 mg,繼以每12 h皮下注射1 mg/kg(前2次最大劑量100 mg)(Ⅰ,A);年齡≥75歲的患者僅需每12 h皮下注射0.75 mg/kg(前2次最大劑量75 mg)。如CrCl<30 ml/min,則不論年齡,每24 h皮下注射1 mg/kg。
(3)靜脈推注磺達肝癸鈉2.5 mg,之後每天皮下注射2.5 mg(Ⅰ,B)。如果CrCl<30 ml/min,則不用磺達肝癸鈉。
3.溶栓後PCI患者
可繼續靜脈應用普通肝素,根據ACT結果及是否使用GPⅡb/Ⅲa受體拮抗劑調整劑量(Ⅰ,C)。
對已使用適當劑量依諾肝素而需PCI的患者,若最後一次皮下注射在8 h之內,PCI前可不追加劑量,若最後一次皮下注射在8~12 h之間,則應靜脈注射依諾肝素0.3 mg/kg(Ⅰ,B)。
4.發病12 h內未行再灌注治療或發病>12 h的患者
須盡快給予抗凝治療,磺達肝癸鈉有利於降低死亡和再梗死,而不增加出血並發症(Ⅰ,B)。
5.預防血栓栓塞
CHA2DS2-VASc評分≥2的房顫患者、心髒機械瓣膜置換術後或靜脈血栓栓塞患者應給予華法林治療,但須注意出血(Ⅰ,C)。
合並無症狀左心室附壁血栓患者應用華法林抗凝治療是合理的(Ⅱa,C)。
DES後接受雙聯抗血小板治療的患者如加用華法林時應控製INR在2.0~2.5(Ⅱb,C)。
出血風險大的患者可應用華法林加氯吡格雷治療(Ⅱa,B)。
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號