組蛋白乙酰化在調節基因表達和染色質結構方麵起著重要作用。細胞核中組蛋白的乙酰化水平由乙酰轉移酶(histone acetyltransferase,HAT)和去乙酰化酶(histone deacetylase,HDAC)共同調控。HDAC抑製劑已被用於多種疾病或癌症的臨床治療。然而,由於HDAC活性位點的結構相似性,目前上市的HDAC抑製劑的特異性有限。研究發現鋅離子依賴的HDAC一般作為催化亞
組蛋白乙酰化在調節基因表達和染色質結構方麵起著重要作用。細胞核中組蛋白的乙酰化水平由乙酰轉移酶(histone acetyltransferase,HAT)和去乙酰化酶(histone deacetylase,HDAC)共同調控。HDAC抑製劑已被用於多種疾病或癌症的臨床治療。然而,由於HDAC活性位點的結構相似性,目前上市的HDAC抑製劑的特異性有限。研究發現鋅離子依賴的HDAC一般作為催化亞基存在於多種轉錄調控複合體中,如SIN3-HDAC、NuRD、CoREST、SMRT/NCoR及MiDAC等。人們漸漸意識到這些複合體對於將HDAC定位於特異染色質區域並實現時空的精準調控至關重要。
SIN3-HDAC複合體作為其中重要的一員,從酵母到人源都是保守的,參與了許多細胞過程,包括發育、生長、分化和衰老等等此外,它們還為多種癌症提供了重要的治療靶標,如三陰性乳腺癌和胰腺癌等。人源Sin3蛋白的雜合突變或缺失可能導致伴有顱麵缺陷的智力障礙綜合症。由於缺乏關鍵的結構信息,長期以來人們對SIN3-HDAC複合體的理解較為滯後。
2023年4月20日,西湖大學生命科學學院施一公團隊在 Nature 子刊 Nature Structural & Molecular Biology 上發表了題為:Structure of a SIN3-HDAC complex from budding yeast 的最新研究論文。
該論文報道了釀酒酵母組蛋白去乙酰酶複合體Rpd3L的結構,揭示了其組裝機製,提出了其靶向染色質的工作模型,並為設計高特異性去乙酰酶抑製劑提供堅實的分子基礎。

研究團隊從釀酒酵母中提取了內源的Rpd3L複合體,並利用單顆粒冷凍電鏡技術解析了該複合體的結構,平均分辨率為 2.6 ?(圖1)。結合高質量冷凍電鏡密度圖與交聯質譜結果,研究人員搭建了含有12個亞基的結構模型(其中包括各兩分子的Sin3和催化亞基Rpd3)。結構分析發現整個複合體由"T "形支架連接ARM1和ARM2形成。
在每個ARM中,Sin3與不同的亞單位相互作用,為組蛋白去乙酰化酶Rpd3創造不同的 “環境”:ARM1處於抑製狀態,Rpd3的酶活中心被封鎖(圖2);而ARM2處於開放構象,Rpd3’的酶活中心暴露在外。結合這些結構特征和以往的報道,研究人員提出了Rpd3L複合體靶向特異染色質區域的工作模型。
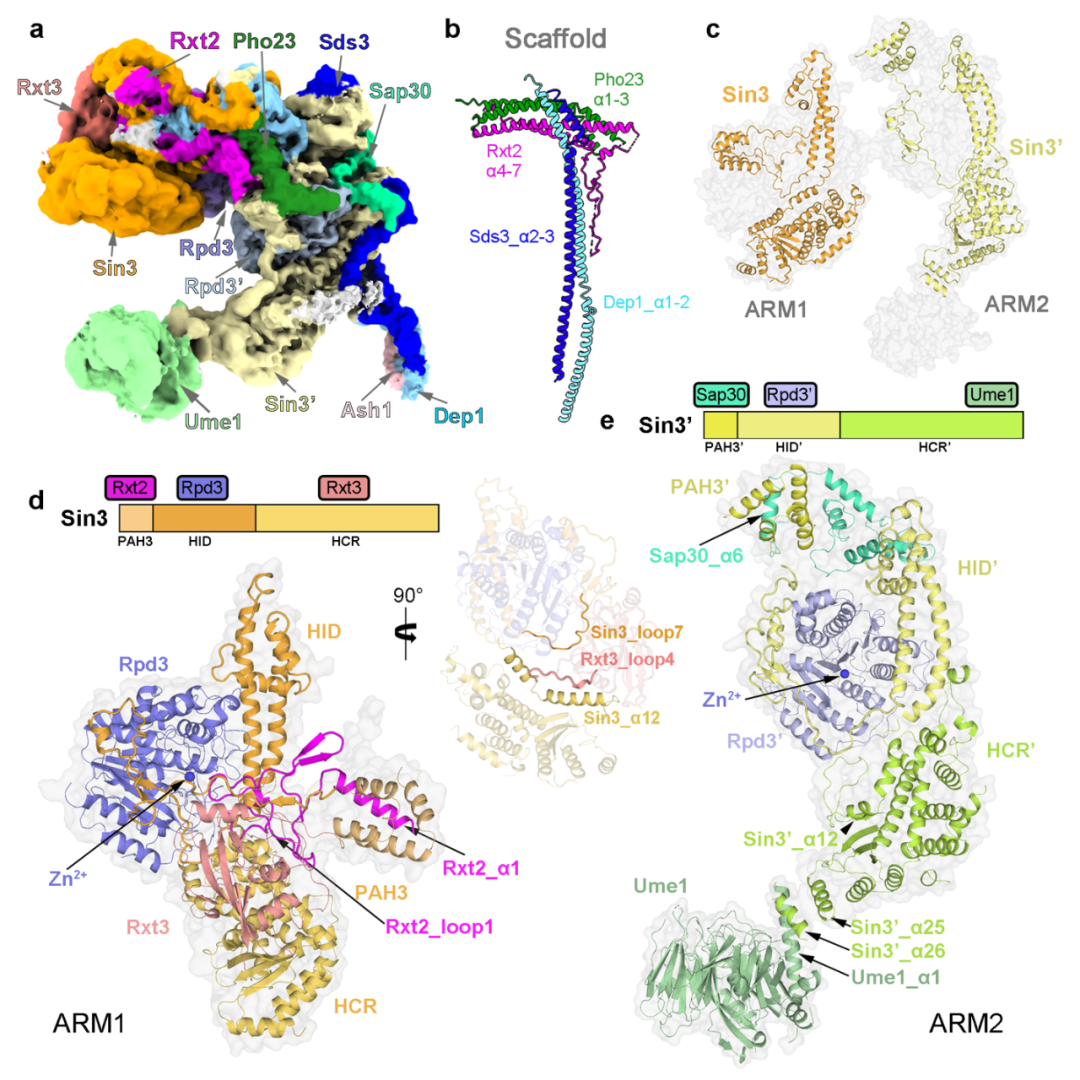
另外,Rpd3L複合體的不對稱結構與其他已發表去乙酰酶複合體的結構有很大的差異。許多基於細胞和動物的研究表明不同的HDAC複合體具有不同的生物活性,影響不同的生理和發育功能。這意味著以HDAC複合體為目標設計藥物可能獲得高特異性。然而,人源SIN3-HDAC複合體的現有結構信息非常有限。酵母Rpd3L複合體的結構解析代表著對SIN3-HDAC複合體的理解向前邁出了一大步,並為設計高特異性藥物提供潛在的策略。
西湖大學生命科學學院施一公團隊副研究員王程程、占謝超為論文共同通訊作者,西湖大學博士生郭舟妍和儲晨為論文共同第一作者。施一公教授為該研究提供了大力支持和建議。西湖大學博士生盧怡辰、原西湖大學助理研究員張曉峰、西湖大學理學院研究員吳明軒和博士生肖義杭參與了本研究的部分工作。北京協和醫院黃超蘭教授和高帥鑫高級工程師參與了質譜部分的工作。
原始出處:
Guo, Z., Chu, C., Lu, Y. et al.Structure of a SIN3–HDAC complex from budding yeast. Nat Struct Mol Biol (2023). https://doi.org/10.1038/s41594-023-00975-z.
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號